Lungetransplantation er den accepterede behandling for fremskreden lungesygdom. I de seneste årtier har lungetransplantation gjort bemærkelsesværdige fremskridt inden for screening og evaluering af transplantationspatienter, udvælgelse, bevarelse og allokering af donorlunger, kirurgiske teknikker, postoperativ behandling, komplikationshåndtering og immunsuppression.
På mere end 60 år har lungetransplantation udviklet sig fra en eksperimentel behandling til den accepterede standardbehandling for livstruende lungesygdomme. Trods almindelige problemer som primær transplantatdysfunktion, kronisk transplantatlungedysfunktion (CLAD), øget risiko for opportunistiske infektioner, kræft og kroniske helbredsproblemer relateret til immunsuppression, er der løfte om at forbedre patienters overlevelse og livskvalitet gennem udvælgelse af den rette modtager. Mens lungetransplantationer bliver mere almindelige rundt om i verden, holder antallet af operationer stadig ikke trit med den stigende efterspørgsel. Denne gennemgang fokuserer på den nuværende status og de seneste fremskridt inden for lungetransplantation, samt fremtidige muligheder for effektiv implementering af denne udfordrende, men potentielt livsændrende behandling.
Evaluering og udvælgelse af potentielle modtagere
Da egnede donorlunger er relativt få, er transplantationscentre etisk forpligtede til at allokere donororganer til potentielle modtagere, der har størst sandsynlighed for at opnå en nettofordel ved transplantation. Den traditionelle definition af sådanne potentielle modtagere er, at de har en estimeret risiko på mere end 50 % for at dø af lungesygdom inden for 2 år og en chance på mere end 80 % for at overleve 5 år efter transplantation, forudsat at de transplanterede lunger er fuldt funktionelle. De mest almindelige indikationer for lungetransplantation er lungefibrose, kronisk obstruktiv lungesygdom, lungekarsygdom og cystisk fibrose. Patienter henvises baseret på nedsat lungefunktion, nedsat fysisk funktion og sygdomsprogression på trods af maksimal brug af medicin og kirurgiske behandlinger. Andre sygdomsspecifikke kriterier tages også i betragtning. Prognostiske udfordringer understøtter tidlige henvisningsstrategier, der giver mulighed for bedre risiko-fordel-rådgivning for at forbedre informeret fælles beslutningstagning og muligheden for at ændre potentielle barrierer for succesfulde transplantationsresultater. Det tværfaglige team vil vurdere behovet for en lungetransplantation og patientens risiko for komplikationer efter transplantation på grund af brug af immunsuppressive midler, såsom risikoen for potentielt livstruende infektioner. Screening for ekstrapulmonal organdysfunktion, fysisk form, mental sundhed, systemisk immunitet og kræft er afgørende. Specifikke vurderinger af koronar- og cerebrale arterier, nyrefunktion, knoglesundhed, spiserørsfunktion, psykosocial kapacitet og social støtte er afgørende, samtidig med at der udvises omhu for at opretholde gennemsigtighed for at undgå uligheder i vurderingen af egnethed til transplantation.
Flere risikofaktorer er mere skadelige end enkelte risikofaktorer. Traditionelle barrierer for transplantation omfatter fremskreden alder, fedme, en historie med kræft, kritisk sygdom og samtidig systemisk sygdom, men disse faktorer er for nylig blevet udfordret. Modtagernes alder stiger støt, og i 2021 vil 34 % af modtagerne i USA være ældre end 65 år, hvilket indikerer en stigende vægt på biologisk alder frem for kronologisk alder. Nu er der, udover den seks minutters gangafstand, ofte en mere formel vurdering af skrøbelighed, der fokuserer på fysiske reserver og forventede reaktioner på stressfaktorer. Skrøbelighed er forbundet med dårlige resultater efter lungetransplantation, og skrøbelighed er normalt forbundet med kropssammensætning. Metoder til beregning af fedme og kropssammensætning fortsætter med at udvikle sig og fokuserer mindre på BMI og mere på fedtindhold og muskelmasse. Værktøjer, der lover at kvantificere vaklen, oligomyose og modstandsdygtighed, udvikles for bedre at forudsige evnen til at komme sig efter lungetransplantation. Med præoperativ lungerehabilitering er det muligt at ændre kropssammensætning og svækkelse og derved forbedre resultaterne.
I tilfælde af akut kritisk sygdom er det særligt udfordrende at bestemme omfanget af svækkelse og evnen til at komme sig. Transplantationer hos patienter, der modtager mekanisk ventilation, var tidligere sjældne, men bliver nu mere almindelige. Derudover er brugen af ekstrakorporal livsstøtte som en overgangsbehandling før transplantation steget i de senere år. Teknologiske fremskridt og vaskulær adgang har gjort det muligt for bevidste, omhyggeligt udvalgte patienter, der gennemgår ekstrakorporal livsstøtte, at deltage i informerede samtykkeprocedurer og fysisk rehabilitering og opnå resultater efter transplantation svarende til dem, der blev opnået hos patienter, der ikke krævede ekstrakorporal livsstøtte før transplantation.
Samtidig systemisk sygdom blev tidligere betragtet som en absolut kontraindikation, men dens indvirkning på resultaterne efter transplantation skal nu evalueres specifikt. Da transplantationsrelateret immunsuppression øger sandsynligheden for tilbagefald af kræft, understregede tidligere retningslinjer for præeksisterende maligniteter kravet om, at patienter skal være kræftfri i fem år, før de placeres på venteliste til transplantation. Men efterhånden som kræftbehandlinger bliver mere effektive, anbefales det nu at vurdere sandsynligheden for tilbagefald af kræft på patientspecifik basis. Systemisk autoimmun sygdom har traditionelt været betragtet som kontraindiceret, et synspunkt, der er problematisk, fordi fremskreden lungesygdom har tendens til at begrænse den forventede levetid for sådanne patienter. De nye retningslinjer anbefaler, at lungetransplantation bør forudgås af en mere målrettet sygdomsvurdering og behandling for at reducere sygdomsmanifestationer, der kan påvirke resultaterne negativt, såsom spiserørsproblemer forbundet med sklerodermi.
Cirkulerende antistoffer mod specifikke HLA-underklasser kan gøre nogle potentielle recipienter allergiske over for specifikke donororganer, hvilket resulterer i længere ventetider, reduceret sandsynlighed for transplantation, akut organafstødning og øget risiko for CLAD. Nogle transplantationer mellem kandidat-recipientantistoffer og donortyper har dog opnået lignende resultater med præoperative desensibiliseringsregimer, herunder plasmaudskiftning, intravenøs immunoglobulin og anti-B-cellebehandling.
Udvælgelse og anvendelse af donorlunge
Organdonation er en altruistisk handling. At indhente donorens samtykke og respektere deres autonomi er de vigtigste etiske faktorer. Donorlunger kan blive beskadiget af brysttraumer, hjerte-lunge-redning, aspiration, emboli, respiratorrelateret skade eller infektion eller neurogen skade, så mange donorlunger er ikke egnede til transplantation. ISHLT (International Society for Heart and Lung Transplantation)
Lungetransplantation definerer generelt accepterede donorkriterier, som varierer fra transplantationscenter til transplantationscenter. Faktisk opfylder meget få donorer de "ideelle" kriterier for lungedonation (Figur 2). Øget udnyttelse af donorlunger er opnået gennem lempelse af donorkriterierne (dvs. donorer, der ikke opfylder konventionelle ideelle standarder), omhyggelig evaluering, aktiv donorpleje og in vitro-evaluering (Figur 2). En historie med aktiv rygning fra donorens side er en risikofaktor for primær transplantatdysfunktion hos recipienten, men risikoen for død ved brug af sådanne organer er begrænset og bør vejes op mod dødelighedskonsekvenserne af en lang ventetid på en donorlunge fra en aldrig-ryger. Brugen af lunger fra ældre (ældre end 70 år) donorer, der er blevet grundigt udvalgt og ikke har andre risikofaktorer, kan opnå lignende resultater for recipientoverlevelse og lungefunktion som dem fra yngre donorer.
Korrekt pleje af flere organdonorer og overvejelse af mulig lungedonation er afgørende for at sikre, at donorlunger har en høj sandsynlighed for at være egnede til transplantation. Selvom få af de lunger, der i øjeblikket tilbydes, opfylder den traditionelle definition af en ideel donorlunge, kan en lempelse af kriterierne ud over disse traditionelle kriterier føre til vellykket udnyttelse af organer uden at gå på kompromis med resultaterne. Standardiserede metoder til lungebevaring hjælper med at beskytte organets integritet, før det implanteres i modtageren. Organer kan transporteres til transplantationsfaciliteter under forskellige forhold, såsom kryostatisk bevaring eller mekanisk perfusion ved hypotermi eller normal kropstemperatur. Lunger, der ikke anses for egnede til øjeblikkelig transplantation, kan evalueres yderligere objektivt og kan behandles med in vitro-lungeperfusion (EVLP) eller bevares i længere perioder for at overvinde organisatoriske barrierer for transplantation. Typen af lungetransplantation, procedure og intraoperativ støtte afhænger alt sammen af patientens behov og kirurgens erfaring og præferencer. For potentielle lungetransplantationspatienter, hvis sygdom forværres dramatisk, mens de venter på en transplantation, kan ekstrakorporal livsstøtte overvejes som en overgangsbehandling før transplantation. Tidlige postoperative komplikationer kan omfatte blødning, obstruktion af luftveje eller vaskulær anastomose og sårinfektion. Skade på phrenicus- eller vagusnerven i brystet kan føre til andre komplikationer, der påvirker henholdsvis diafragmafunktionen og mavetømningen. Donorlungen kan have tidlig akut lungeskade efter implantation og reperfusion, dvs. primær transplantatdysfunktion. Det er meningsfuldt at klassificere og behandle sværhedsgraden af primær transplantatdysfunktion, som er forbundet med en høj risiko for tidlig død. Da potentiel donorlungeskade opstår inden for timer efter den første hjerneskade, bør lungebehandlingen omfatte korrekt ventilation, alveolær reekspansion, bronkoskopi og aspiration og lavage (til prøveudtagning af kulturer), patientens væskehåndtering og justering af brystposition. ABO står for blodgruppe A, B, AB og O, CVP står for centralt venetryk, DCD står for lungedonor fra hjertedød, ECMO står for ekstrakorporeal membranoxygenering, EVLW står for ekstravaskulær pulmonal vand, PaO2/FiO2 står for forholdet mellem arterielt partialtryk og inhaleret iltkoncentration, og PEEP står for positivt slutekspiratorisk tryk. PiCCO repræsenterer hjertets minutvolumen for pulsindeksbølgeformen.
I nogle lande er brugen af kontrolleret donorlunge (DCD) steget til 30-40 % hos patienter med hjertedød, og lignende rater for akut organafstødning, CLAD og overlevelse er opnået. Traditionelt bør organer fra inficerede donorer undgås til transplantation til uinficerede modtagere. I de senere år har antivirale lægemidler, der virker direkte mod hepatitis C-virus (HCV), imidlertid gjort det muligt at transplantere HCV-positive donorlunger sikkert til HCV-negative modtagere. Tilsvarende kan human immundefektvirus (HIV)-positive donorlunger transplanteres til HIV-positive modtagere, og hepatitis B-virus (HBV)-positive donorlunger kan transplanteres til modtagere, der er blevet vaccineret mod HBV, og dem, der er immune. Der har været rapporter om lungetransplantationer fra aktive eller tidligere SARS-CoV-2-inficerede donorer. Vi har brug for mere evidens for at fastslå sikkerheden ved at inficere donorlunger med infektiøse vira til transplantation.
På grund af kompleksiteten ved at udtage flere organer er det udfordrende at vurdere kvaliteten af donorlunger. Brug af et in vitro-lungeperfusionssystem til evaluering muliggør en mere detaljeret vurdering af donorlungefunktionen og potentialet for at reparere den før brug (Figur 2). Da donorlungen er meget modtagelig for skader, giver in vitro-lungeperfusionssystemet en platform for administration af specifikke biologiske terapier til at reparere den beskadigede donorlunge (Figur 2). To randomiserede forsøg har vist, at in vitro-lungeperfusion af donorlunger med normal kropstemperatur, der opfylder konventionelle kriterier, er sikker, og at transplantationsteamet kan forlænge konserveringstiden på denne måde. Konservering af donorlunger ved højere hypotermi (6 til 10 °C) i stedet for 0 til 4 °C på is har vist sig at forbedre mitokondriesundheden, reducere skader og forbedre lungefunktionen. For semi-selektive dagtransplantationer har længere konservering natten over vist sig at opnå gode resultater efter transplantation. Et stort ikke-inferiørt sikkerhedsforsøg, der sammenligner konservering ved 10 °C med standard kryopræservering, er i øjeblikket i gang (registreringsnummer NCT05898776 på ClinicalTrials.gov). Folk opfordrer i stigende grad til rettidig organgenopretning gennem multiorgandonorcentre og forbedring af organfunktionen gennem organreparationscentre, så organer af bedre kvalitet kan bruges til transplantation. Virkningen af disse ændringer i transplantationsøkosystemet vurderes stadig.
For at bevare kontrollerbare DCD-organer kan lokal perfusion af normal kropstemperatur in situ via ekstrakorporal membranoxygenering (ECMO) anvendes til at vurdere funktionen af abdominale organer og understøtte direkte erhvervelse og bevarelse af thoraxorganer, herunder lungerne. Erfaring med lungetransplantation efter lokal perfusion af normal kropstemperatur i bryst og abdomen er begrænset, og resultaterne er blandede. Der er bekymring for, at denne procedure kan forårsage skade på afdøde donorer og krænke de grundlæggende etiske principper for organhøstning. Derfor er lokal perfusion ved normal kropstemperatur endnu ikke tilladt i mange lande.
Kræft
Forekomsten af kræft i befolkningen efter lungetransplantation er højere end i den generelle befolkning, og prognosen har en tendens til at være dårlig og tegner sig for 17 % af dødsfaldene. Lungekræft og lymfoproliferativ sygdom efter transplantation (PTLD) er de mest almindelige årsager til kræftrelateret død. Langvarig immunsuppression, virkningerne af tidligere rygning eller risikoen for underliggende lungesygdom fører alle til risikoen for at udvikle lungekræft i en enkelt lungemodtagers egen lunge, men i sjældne tilfælde kan donoroverført subklinisk lungekræft også forekomme i transplanterede lunger. Ikke-melanom hudkræft er den mest almindelige kræftform blandt transplantationspatienter, så regelmæssig overvågning af hudkræft er afgørende. B-celle PTLD forårsaget af Epstein-Barr-virus er en vigtig årsag til sygdom og død. Selvom PTLD kan forsvinde med minimal immunsuppression, er B-celle målrettet behandling med rituximab, systemisk kemoterapi eller begge dele normalt påkrævet.
Overlevelse og langsigtede resultater
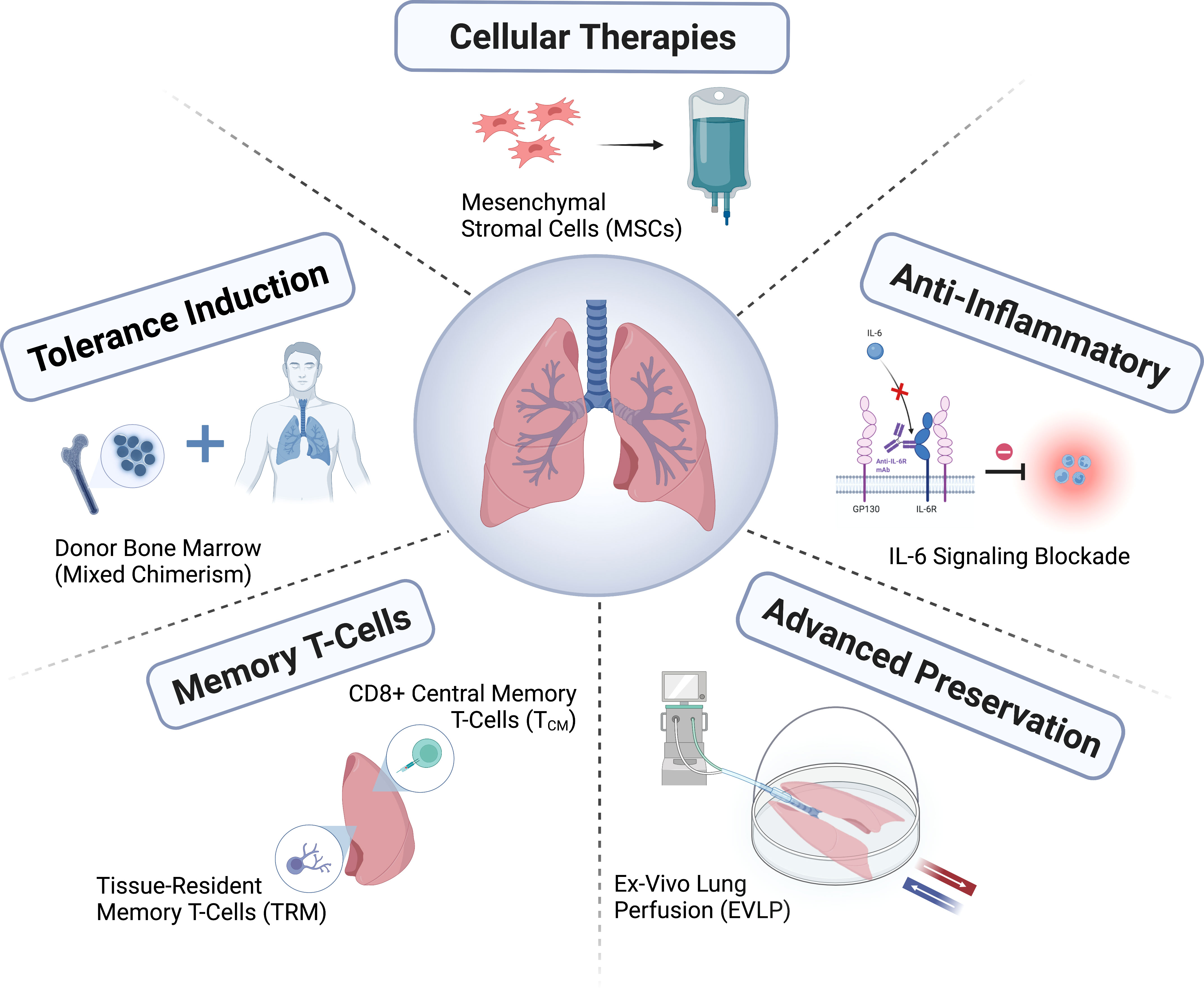
Overlevelse efter lungetransplantation er fortsat begrænset sammenlignet med andre organtransplantationer, med en median på 6,7 år, og der er gjort få fremskridt i patienternes langsigtede resultater over tre årtier. Mange patienter oplevede dog betydelige forbedringer i livskvalitet, fysisk tilstand og andre patientrapporterede resultater. For at kunne foretage en mere omfattende vurdering af de terapeutiske virkninger af lungetransplantation er det nødvendigt at være mere opmærksom på de resultater, som disse patienter rapporterer. Et vigtigt udækket klinisk behov er at adressere recipientens død som følge af fatale komplikationer af forsinket transplantatsvigt eller langvarig immunsuppression. For lungetransplantationspatienter bør der gives aktiv langtidspleje, hvilket kræver teamwork for at beskytte recipientens generelle helbred ved at overvåge og opretholde transplantatfunktionen på den ene side, minimere de negative virkninger af immunsuppression og støtte recipientens fysiske og mentale helbred på den anden side (Figur 1).
Fremtidig retning
Lungetransplantation er en behandling, der har udviklet sig meget på kort tid, men som endnu ikke har nået sit fulde potentiale. Manglen på egnede donorlunger er fortsat en stor udfordring, og nye metoder til vurdering og pleje af donorer, behandling og reparation af donorlunger og forbedring af donorbevarelse er stadig under udvikling. Det er nødvendigt at forbedre organallokeringspolitikkerne ved at forbedre matchningen mellem donorer og modtagere for yderligere at øge nettofordelene. Der er en stigende interesse for at diagnosticere afstødning eller infektion gennem molekylær diagnostik, især med donorafledt frit DNA, eller for at vejlede minimeringen af immunsuppression. Imidlertid er nytten af denne diagnostik som et supplement til nuværende kliniske transplantatmonitoreringsmetoder endnu ikke fastlagt.
Lungetransplantationsfeltet har udviklet sig gennem dannelsen af konsortier (f.eks. ClinicalTrials.gov registreringsnummer NCT04787822; https://lungtransplantconsortium.org) og måder at arbejde sammen på, vil bidrage til forebyggelse og behandling af primær transplantatdysfunktion, CLAD-prognose, tidlig diagnose og indre punkter (endotyping), refine syndrom. Der er gjort hurtigere fremskridt i studiet af primær transplantatdysfunktion, antistofmedieret afstødning, ALAD- og CLAD-mekanismer. Minimering af bivirkninger og reduktion af risikoen for ALAD og CLAD gennem personlig immunsuppressiv behandling, samt definition af patientcentrerede resultater og inkorporering af dem i effektmål, vil være nøglen til at forbedre den langsigtede succes med lungetransplantation.
Opslagstidspunkt: 23. november 2024