Kakeksi er en systemisk sygdom, der er karakteriseret ved vægttab, atrofi af muskel- og fedtvæv og systemisk inflammation. Kakeksi er en af de vigtigste komplikationer og dødsårsager hos kræftpatienter. Ud over kræft kan kakeksi være forårsaget af en række kroniske, ikke-maligne sygdomme, herunder hjertesvigt, nyresvigt, kronisk obstruktiv lungesygdom, neurologiske sygdomme, AIDS og leddegigt. Det anslås, at forekomsten af kakeksi hos kræftpatienter kan nå op på 25 % til 70 %, hvilket alvorligt påvirker patienternes livskvalitet og forværrer behandlingsrelateret toksicitet.
Effektiv intervention mod kakeksi er af stor betydning for at forbedre livskvaliteten og prognosen for kræftpatienter. Trods visse fremskridt i studiet af de patofysiologiske mekanismer ved kakeksi er mange lægemidler, der er udviklet baseret på mulige mekanismer, kun delvist effektive eller ineffektive. Der findes i øjeblikket ingen effektiv behandling godkendt af den amerikanske fødevare- og lægemiddelstyrelse (FDA).
Der er mange årsager til, at kliniske forsøg med kakeksi mislykkes, og den grundlæggende årsag kan ligge i manglen på en grundig forståelse af mekanismen og det naturlige forløb af kakeksi. For nylig udgav professor Xiao Ruiping og forsker Hu Xinli fra College of Future Technology ved Peking University i fællesskab en artikel i Nature Metabolism, der afslører den vigtige rolle, som lactate-GPR81-signalvejen spiller i forekomsten af kræftkakeksi, og giver en ny idé til behandling af kakeksi. Vi opsummerer dette ved at syntetisere artikler fra Nat Metab, Science, Nat Rev Clin Oncol og andre tidsskrifter.
Vægttab skyldes normalt reduceret fødeindtag og/eller øget energiforbrug. Tidligere undersøgelser har antydet, at disse fysiologiske ændringer i tumorassocieret kakeksi er drevet af visse cytokiner, der udskilles af tumormikromiljøet. For eksempel kan faktorer som vækstdifferentieringsfaktor 15 (GDF15), lipocalin-2 og insulinlignende protein 3 (INSL3) hæmme fødeindtaget ved at binde sig til appetitregulerende steder i centralnervesystemet, hvilket fører til anoreksi hos patienter. IL-6, PTHrP, activin A og andre faktorer driver vægttab og vævsatrofi ved at aktivere den katabolske bane og øge energiforbruget. I øjeblikket har forskning i mekanismen bag kakeksi primært fokuseret på disse udskilte proteiner, og få undersøgelser har involveret sammenhængen mellem tumormetabolitter og kakeksi. Professor Xiao Ruiping og forsker Hu Xinli har taget en ny tilgang til at afdække den vigtige mekanisme bag tumorrelateret kakeksi set fra tumormetabolitternes perspektiv.
Først screenede professor Xiao Ruipings team tusindvis af metabolitter i blodet fra raske kontrolpersoner og musemodeller for lungekræftkakeksi og fandt, at mælkesyre var den mest signifikant forhøjede metabolit hos mus med kakeksi. Serumniveauet af mælkesyre steg med tumorvækst og viste en stærk korrelation med vægtændringen hos tumorbærende mus. Serumprøver indsamlet fra lungekræftpatienter bekræfter, at mælkesyre også spiller en nøglerolle i udviklingen af menneskelig kræftkakeksi.
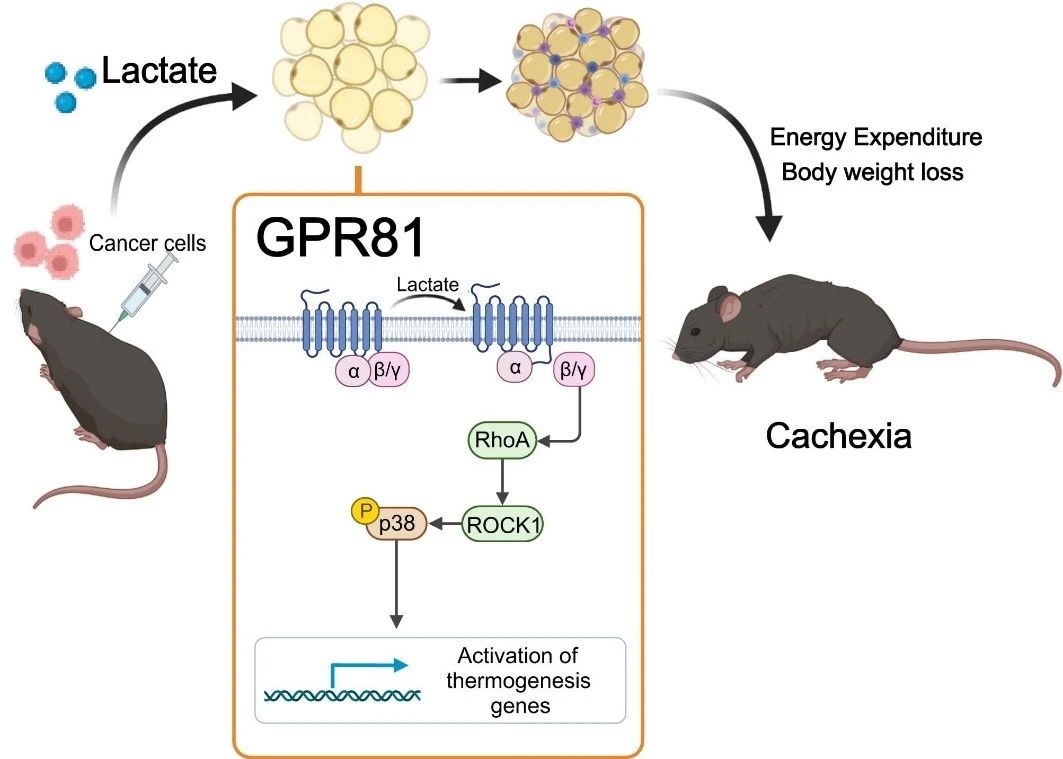
For at afgøre, om høje niveauer af mælkesyre forårsager kakeksi, tilførte forskerholdet mælkesyre til blodet hos raske mus gennem en osmotisk pumpe implanteret under huden, hvilket kunstigt hævede serummælkesyreniveauerne til niveauet hos mus med kakeksi. Efter 2 uger udviklede musene en typisk fænotype af kakeksi, såsom vægttab, fedt- og muskelvævsatrofi. Disse resultater tyder på, at laktatinduceret fedtombygning ligner den, der induceres af kræftceller. Laktat er ikke kun en karakteristisk metabolit for kræftkakeksi, men også en vigtig mediator af kræftinduceret hyperkatabolisk fænotype.
Dernæst fandt de, at deletion af laktatreceptoren GPR81 var effektiv til at lindre tumor- og serumlaktatinducerede kakeksi-manifestationer uden at påvirke serumlaktatniveauerne. Fordi GPR81 er i høj grad udtrykt i fedtvæv og ændrer sig i fedtvæv tidligere end skeletmuskulatur under udviklingen af kakeksi, ligner den specifikke knockout-effekt af GPR81 i musefedtvæv den, der ses ved systemisk knockout, hvilket forbedrer tumorinduceret vægttab og fedt- og skeletmuskulaturforbrug. Dette tyder på, at GPR81 i fedtvæv er påkrævet for udviklingen af kræftkakeksi drevet af mælkesyre.
Yderligere undersøgelser bekræftede, at mælkesyremolekyler efter binding til GPR81 driver fedtbrunning, lipolyse og øget systemisk varmeproduktion gennem Gβγ-RhoA/ROCK1-p38-signalvejen snarere end den klassiske PKA-vej.
Trods lovende resultater inden for patogenesen af kræftrelateret kakeksi er disse fund endnu ikke blevet omsat til effektive behandlinger, så der findes i øjeblikket ingen behandlingsstandarder for disse patienter, men nogle selskaber, såsom ESMO og European Society of Clinical Nutrition and Metabolism, har udviklet kliniske retningslinjer. I øjeblikket anbefaler internationale retningslinjer kraftigt at fremme metabolisme og reducere katabolisme gennem tilgange som ernæring, motion og medicinering.
Opslagstidspunkt: 28. april 2024