I dag er ikke-alkoholisk fedtleversygdom (NAFLD) blevet den primære årsag til kronisk leversygdom i Kina og endda i verden. Sygdomsspektret omfatter simpel hepatisk steatohepatitis, ikke-alkoholisk steatohepatitis (NASH) og relateret cirrose og leverkræft. NASH er karakteriseret ved overdreven fedtophobning i hepatocytter og induceret cellulær skade og inflammation, med eller uden leverfibrose. Sværhedsgraden af leverfibrose hos NASH-patienter er tæt forbundet med dårlig leverprognose (cirrose og dens komplikationer og hepatocellulært carcinom), kardiovaskulære hændelser, ekstrahepatiske maligniteter og død af alle årsager. NASH kan have en negativ indvirkning på patienters livskvalitet; der er dog ikke godkendt lægemidler eller terapier til behandling af NASH.
Et nyligt studie (ENLIVEN) offentliggjort i New England Journal of Medicine (NEJM) viste, at pegozafermin forbedrede både leverfibrose og leverinflammation hos biopsi-bekræftede ikke-cirrhotiske NASH-patienter.
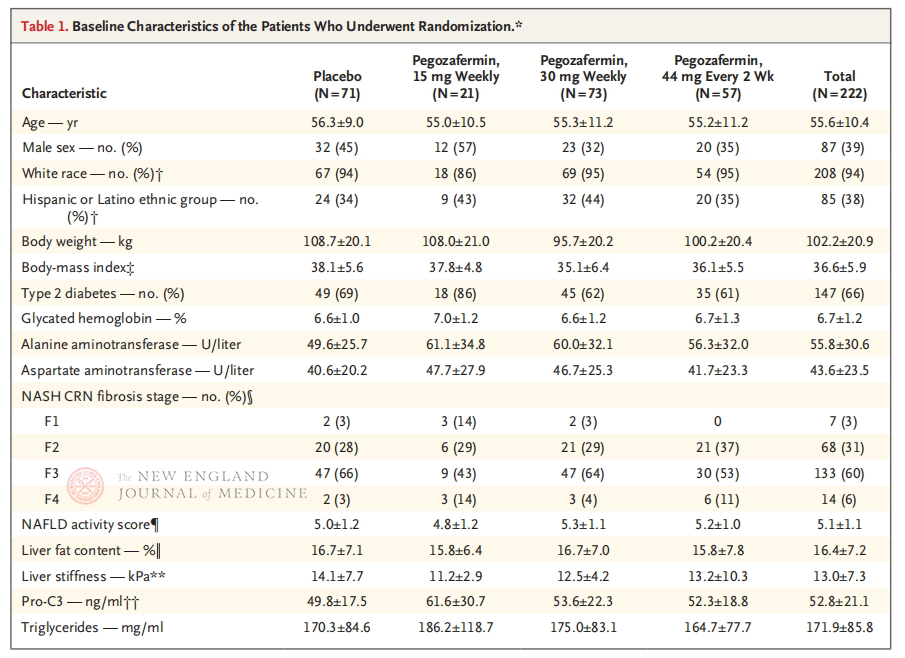
Det multicenter, randomiserede, dobbeltblindede, placebokontrollerede fase 2b kliniske forsøg, udført af professor Rohit Loomba og hans kliniske team ved University of California, San Diego School of Medicine, inkluderede 222 patienter med biopsi-bekræftet stadium F2-3 NASH mellem 28. september 2021 og 15. august 2022. De blev tilfældigt tildelt pegozafermin (subkutan injektion, 15 mg eller 30 mg én gang om ugen eller 44 mg én gang hver 2. uge) eller placebo (én gang om ugen eller én gang hver 2. uge). Primære endepunkter omfattede ≥ stadium 1 forbedring i fibrose og ingen progression af NASH. NASH forsvandt uden fibrotisk progression. Studiet udførte også en sikkerhedsvurdering.
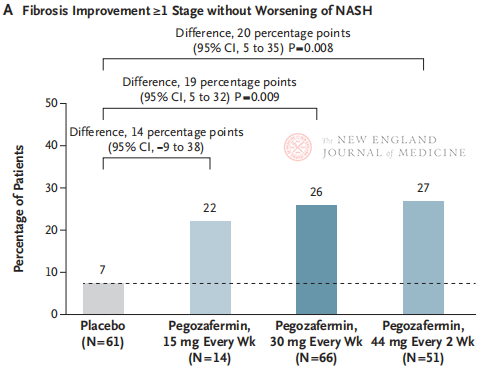
Efter 24 ugers behandling var andelen af patienter med ≥ stadium 1 forbedring i fibrose og ingen forværring af NASH, og andelen af patienter med regression af NASH og ingen forværring af fibrose, signifikant højere i de tre Pegozafermin-dosisgrupper end i placebogruppen, med mere signifikante forskelle hos patienter behandlet med 44 mg én gang hver anden uge eller 30 mg én gang om ugen. Med hensyn til sikkerhed var pegozafermin sammenlignelig med placebo. De mest almindelige bivirkninger forbundet med pegozaferminbehandling var kvalme, diarré og erytem på injektionsstedet. I dette fase 2b-forsøg tyder foreløbige resultater på, at behandling med pegozafermin forbedrer leverfibrose.
Pegozafermin, der anvendes i dette studie, er en langtidsvirkende glykolyseret analog af human fibroblastvækstfaktor 21 (FGF21). FGF21 er et endogent metabolisk hormon, der udskilles af leveren, og som spiller en rolle i reguleringen af lipid- og glukosemetabolismen. Tidligere undersøgelser har vist, at FGF21 har terapeutiske virkninger på NASH-patienter ved at øge leverens insulinfølsomhed, stimulere fedtsyreoxidation og hæmme lipogenese. Den korte halveringstid for naturligt FGF21 (ca. 2 timer) begrænser dog dets anvendelse i klinisk behandling af NASH. Pegozafermin anvender glykosyleret pegyleringsteknologi til at forlænge halveringstiden for naturligt FGF21 og optimere dets biologiske aktivitet.
Ud over de positive resultater i dette fase 2b kliniske forsøg viste et andet nyligt studie offentliggjort i Nature Medicine (ENTRIGUE), at pegozafermin også signifikant reducerede triglycerider, ikke-HDL-kolesterol, apolipoprotein B og hepatisk steatose hos patienter med svær hypertriglyceridæmi, hvilket kan have en positiv indvirkning på at reducere risikoen for kardiovaskulære hændelser hos patienter med NASH.
Disse studier tyder på, at pegozafermin, som et endogent metabolisk hormon, kan give flere metaboliske fordele til patienter med NASH, især fordi NASH i fremtiden kan blive omdøbt til metabolisk associeret fedtleversygdom. Disse resultater gør det til et meget vigtigt potentielt lægemiddel til behandling af NASH. Samtidig vil disse positive studieresultater understøtte pegozafermins indledende fase 3 kliniske forsøg.
Selvom både behandling med 44 mg pegozafermin hver anden uge eller 30 mg ugentlig behandling opnåede det histologiske primære endepunkt i forsøget, var behandlingsvarigheden i dette studie kun 24 uger, og compliance-raten i placebogruppen var kun 7 %, hvilket var signifikant lavere end resultaterne af tidligere kliniske studier, der varede 48 uger. Er forskellene og sikkerheden den samme? I betragtning af NASH's heterogenitet er der behov for større, multicenter, internationale kliniske forsøg i fremtiden for at inkludere større patientpopulationer og forlænge behandlingsvarigheden for bedre at kunne evaluere lægemidlets effekt og sikkerhed.
Opslagstidspunkt: 16. september 2023